Los Enlaces Químicos
Es un diagrama, donde el símbolo del átomo es rodeado por puntos, aspas o círculos que correspondan al número de electrones de valencia del elemento. Ejm:
Los símbolos de puntos de Lewis muestran los electrones de valencia que tiene un átomo de un elemento dado.
*El diagrama de lewis de los átomos de Be, B y C, corresponden al estado hibridizado (mezcla de orbitales)*.
___________________________________________________________
La electronegatividad es una medida en que la fuerza de atracción que ejerce un áomo sobre los electrones , de otro en un enlace covalente .
En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina. Así, según la diferencia entre las electronegatividades de éstos se puede determinar (convencionalmente) si el enlace será, según la escala de Linus Pauling:
* Iónico (diferencia superior o igual a 1.7).
*Covalene polar (diferencia entre 1.7 y 0.4).
*Covalente no polar (diferencia inferior a 0.4).
* Se Nota en el cuadro que:
1) Hibridización es una mezcla de Orbitales.
2) Los no Metales son muy electronegativos, correspondindo el valor mas alto del fluor (F).
3) Los Metles son muy electronegativos, correspondindo el vlor más bajo al Cesio (Elemento estable) y al Francio (elemeno radiactivo).


En la cantidad de energía que se necesita para desalojar el elecrón de más alta nergía en un áomo gaseoso. Un ión puede a su vez perder un segundo electrón al agregar una cantidad adicional de energía llamada "Segunda energía de Ionización".
*Ejemplo:
___________________________________________________________
Afinidad Electrónica
La afinidad electrónica es la cantidad de energía absorbida por un átomo que es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos ; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica.


__________________________________________________________
La Regla del Octeno
La regla del octeto dice que, la tendencia de los átomos de los elementos del sistema periódico, es completar sus últimos niveles de energía con una cantidad de electrones tal que adquiere una configuración semejante a la de un gas noble, ubicados al extremo derecho de la tabla periódica y son inertes, o sea que es muy difícil que reaccionen con algún otro elemento pese a que son elementos electroquímicamente estables, ya que cumplen con la ley de lewis, ó regla del octeto.

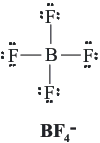
________________________________________________________
El Enlace Químico

Un enlace químico es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeno.
*Tipos de Enlace:
El enlace entre dos átomos nunca se corresponde exactamente con una de las siguientes categorías. Sin embargo, son útiles para clasificar muchas de las propiedades y reactividad química de una gran variedad de compuestos.
1) Covalente: Caracterizado por la compartición de electrónes de valencia de los átomos, se divide en:
a) Normal: El par de electrónes del enlace es apartado por ambos átomos, tenemos:
* Apolar: El par de electrónes no tiende a ninguno de los átomos; es decir, es compartido democráticamente. Se originaentre átomos de Igual electronegatividad.
* Polar: El par de electrónes tiende o está más cerca a uno de los átomos (al de mayor electronegatividad) que trae como consecuencia la formación de polos sin que se llegue a formar iones.
b) Coordinado: El par de electrónes del enlace es aportado solamente por uno de los átomos.
*Enlace múltiple de pares de electrónes:
Algunos átomos pueden compartir sus electrónes por doble o triple covalencia.
*Moléculas Polares y No Polares:
Si el tipo de enlace es polar no significa que la molécula sea polar; dependerá de las características geométricas de la molécula. La determinación de la forma de las moléculas no es tarea fácil, sin embargo se ha ha llegado a determinar la distribución especial de algunas moléculas importantes.
"¿Cómo conocer si es o no polar una molécula, conociendo su forma?"
Si el centro de los polos positivos coinciden con el centro de los polos negativos, entonces la molécula es no polar, en caso contrario (cuando coincidan) la molécula es polar".
*No Olvidar: "La presencia de enlaces polares no indica necesariamente que la molécula sea también polar".
* Observación: La regla que se ha dado para reconocer la polaridad o no de una molécula, se fundamenta en el resultante de momentos dipolares. En una molécula no polar la resultante del momento dipolar es cero y en moléculas polares es diferente de cero.

2) Electrovalente o iónico: Caracterizado por la transferencia de electrónes de un átomo a otro. La transferencia se produce por la gran diferencia de electronegatividad entre los átomos.
Enlace iónico se produce generalmente cuando la diferencia de electronegatividad es mayor que 1.7 o que el porcentaje de caracter iónico es mayor que 50%.
* Nota: Un enlace Iónico se produce generalmente entre un metal y no metal y un enlace covalente entre no metales, pero no siempre; porque existen moléculas covalentes formados por un no metal y metal.
* El Compuesto Iónico posee las suientes características:
a) Conducen la corriente eléctrica en solución o en estado líquido.
b) Tienen puntos de fusión y ebullición relativamente altos.
c) Se disuelven con facilidad en disolventes polares y son poco solubles en disolventes no polares.
d) Al estado sólido presentan estructura cristalina.

3) Enlace Intermolecular:
*Compuestos Iónicos:
No están formados de moléculas, sino de iones que se encuentran unidos por enlace iónico
*Compuestos Covalentes:
Enlace intermolecular, son las fuerzas que mantiene unidas las moléculas polares o no polares. Las moléculas polares se mantienen unidas por las fuerzas llamadas "Dipolo-Dipolo". Las moléculas no polares se hallan unidas por las fuerzas de Vander Walls
*Fuerza de Vander Walls:
Fuerzas intermoleculares que mantienen unidas a las moléculas covalentes no polares, estas fuerzas aparecen como consecuencia de un desarreglo electrónico momentaneo que inducen la aparición de "polos", estas fuerzas son momentaneas y débiles.
*Solubilidad y Punto de Ebullición de las Sustancias:
Muchas de las propiedades físicas de las sustancias dependen del tipo de enlace entre sus átomos o moléculas.Generalmente, las sustancias se disuelven entre semejantes; es por eso que los hidrocarburos son insolubles en agua.El punto de ebullición y fusión dependen directamente de la fuerza de atracción entre sus átomos o moléculas.
La fuerza de atracción en compuestos: Iónicos > Polares > No Polares en efecto: Punto de ebullición y fusión de: Iónicos > Polares > No polares.

4) Enlace Metálico:
Los átomos de un metal tienen la tendencia a ceder electrónes y formar iones positivos, por eso es que en estos elementos no encontramos propiamente átomos sino iones positivosLo iones no se repelen porque son neutralizados por una nube de electrones llamados electrones libres, estos al desplegarse generan el fluído eléctrico o corriente eléctrica.En efecto: el enlace metálico es la unión de los átomos de u metal mediante electrones libres.


_______________________________________________________
La Hidridización
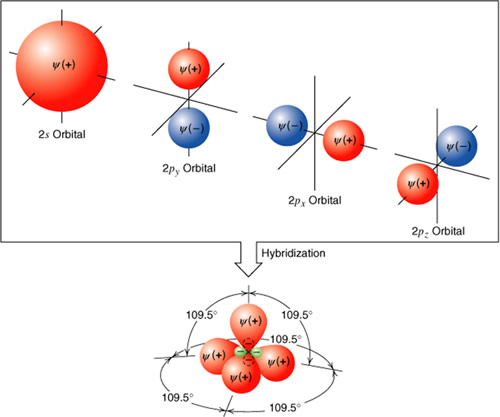

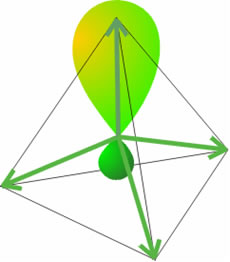
En química, se habla de hibridación cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva, un orbital híbrido que describa la forma en que en la realidad se disponen los electrones para producir las propiedades que se observan en los enlaces atómicos.
*Proceso de hibridización:
1) Creación de un estado excitado que implica desacoplamiento de electrónes, seguidos por el ascenso del electrón a un orbital de mayor energía.
2) Los orbitales puros en el átomo excitado se mezclan para formar orbitales híbridos equivalentes y con orientaciones definidas en el espacio.
*Tipos de enlace:
a) Sigma: Ocurre cuando los orbitales que forman el enlace tienen coincidente el eje
b) Pi: Ocurre cuando los orbitales que forman el enlace tienen paralelo el eje intermolecular de enlace
*Características de los enlaces Sigma y Pi:
Los hidrocarburos no saturados tienen como características de poseer en su estructura enlaces Pi y enlaces Sigma.Los enlaces Pi son relativamente débiles, de ahí que los cmpuestos de doble o triple enlace son más reactivos que compuestos de simple enlace (sigma).
_______________________________________________________
Valencia y Estado de Oxidación
La valencia atómica, o valencia de un átomo es el número de electrones que están siendo compartidos por un átomo en un enlace iónico o covalente. La valencia no debe confundirse con un concepto relacionado pero algo más avanzado, el estado de oxidación.
De forma aislada, un átomo o elemento químico puede describirse con sus posibles valencias, que son los números de valencia que más frecuentemente utiliza al combinarse con otros elementos, y que son el resultado de su configuración electrónica en la capa de valencia.
*Valencia (V): Número de electónes que puede ganar, perder o compartir sus átomos al combinarse con otros. También se puede definir como la capacidad de combinación de un elemento.
*Estado de Oxidación (E.O.): Es la carga o la aparente carga que tien un átomo debido a la transferencia o compartición desigual de electrónes.

* En la transferencia se presentan dos casos:
a) Si el átomo pierde uno o más electrónes, entonces el estado de oxidación es positivo.
b) Si el átomo gana uno o más electrónes, entonces el estado de oxidación es negativo.
* En la compartición desigual también se presentan dos casos:
a) Si el átomo esta "perdiendo" aparentemente uno o más electrónes, entonces el estado de oxidación es positivo
b) Si el átomo está "ganando" aparentemente uno o más electrónes, entonces el estado de oxidación es negativo.
Nótese que numericamente o en valor absoluto no siempre no siempre son iguales la valencia y el estado de oxidación, así en el peroxido de hidrógeno: el estado de oxidación del oxígeno es -1 (caomparte desigualmente un electrón), mientras que su valencia es 2 (comparte 2 electrónes, sin tener en cuenta la desigualdad o igual compartición).




2 comentarios:
felicidades tu pagina esta muy completa y especificada
quede completamente conforme
atte Eulises
No pues el más importante
Publicar un comentario